¡Importante avance! La Agencia Europea del Medicamento se prepara para aprobar lecanemab, el controvertido fármaco contra el Alzheimer
2024-11-15
Autor: Manuel
El lecanemab se perfila como una de las alternativas más prometedoras en la lucha contra el Alzheimer, una enfermedad devastadora que afecta a millones de personas en todo el mundo. Sin embargo, su camino hacia la aprobación no ha estado exento de controversias.
Reciente cambio de opinión. El Comité de Medicamentos de Uso Humano (CHMP) de la Agencia Europea del Medicamento (EMA) ha dado un giro inesperado al recomendar la comercialización de Leqembi, el nombre comercial de lecanemab. Este cambio es significativo, ya que en verano la EMA había decidido no autorizar su uso en la Unión Europea. Esto ha generado un gran interés y cierto escepticismo entre los profesionales de la salud y los pacientes.
La decisión del CHMP, aunque no es obligatoria, suele ser seguida por la EMA. Se anticipa que lecanemab será aprobado, pero vendrá con restricciones específicas para minimizar los riesgos de efectos secundarios, lo cual es crucial para garantizar la seguridad de los pacientes.
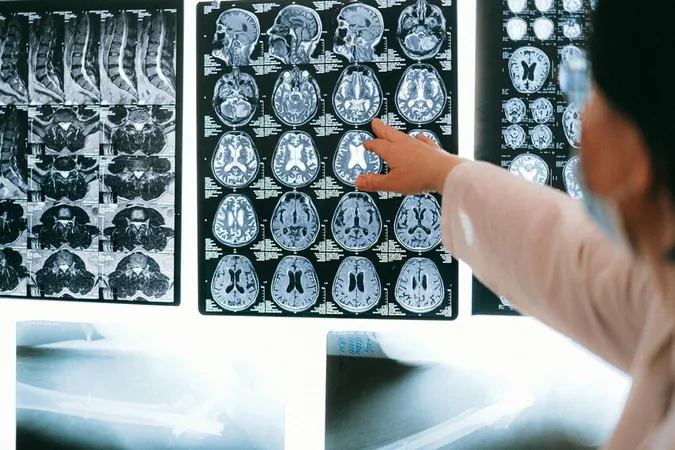
¿Qué es el lecanemab? Este medicamento se dirige al deterioro cognitivo leve provocado por la enfermedad de Alzheimer en adultos, así como a la enfermedad en fases tempranas, según la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Los ensayos clínicos han demostrado una eficacia notable, con una reducción del 27% en la progresión de los síntomas asociados al Alzheimer, observado en un estudio con casi 1.800 participantes.
Sin embargo, no todo son buenas noticias. Aunque el medicamento muestra eficacia, también presenta riesgos significativos. Se han documentado reacciones adversas, entre ellas edemas y hemorragias, que son preocupantes para los médicos y los pacientes. Estas complicaciones están relacionadas con la aparición de anomalías de imagen vinculadas al amiloide (ARIA), que pueden intensificarse cuando se utilizan tratamientos como lecanemab, que actúan sobre la beta amiloide.
El perfil de efectos secundarios y el costo elevado del tratamiento, junto con su enfoque específico en las etapas iniciales de la enfermedad, son obstáculos que limitan su uso generalizado. Desde su lanzamiento, el precio ha sido un tema de debate, ya que muchos pacientes no podrán costearlo sin el apoyo de sistemas de salud pública.
¿Qué ha cambiado en la regulación? Tras una revisión en julio, el CHMP inicialmente rechazó la aprobación del tratamiento para todos los pacientes de Alzheimer en etapas tempranas. Sin embargo, ante la presión de las empresas farmacéuticas, ha habido un cambio de criterio, permitiendo el acceso, pero bajo condiciones más severas. Solo aquellos con una o ninguna copia del gen ApoE4 podrán recibir el medicamento, reduciendo así el riesgo de complicaciones.
Además, se implementarán medidas de prevención, como la exigencia de resonancias magnéticas para controlar ARIA antes de comenzar el tratamiento y durante las dosis subsecuentes.
Próximos pasos a seguir. Ahora, la Comisión Europea deberá otorgar la autorización a nivel de la Unión Europea. Posteriormente, cada país miembro tendrá que autorizar el uso del fármaco a nivel nacional, acercando así a muchos pacientes a una posible nueva esperanza en su lucha contra el Alzheimer. Otros países, como Estados Unidos, China y Japón, ya han dado un paso adelante en la aprobación de este tratamiento.
Con la ciencia en constante avance y nuevas tecnologías en el horizonte, la comunidad médica mantiene la esperanza de que tratamientos como el lecanemab no solo ayuden a frenar el Alzheimer, sino que marquen el inicio de una revolución en su tratamiento.





 Brasil (PT)
Brasil (PT)
 Canada (EN)
Canada (EN)
 Chile (ES)
Chile (ES)
 España (ES)
España (ES)
 France (FR)
France (FR)
 Hong Kong (EN)
Hong Kong (EN)
 Italia (IT)
Italia (IT)
 日本 (JA)
日本 (JA)
 Magyarország (HU)
Magyarország (HU)
 Norge (NO)
Norge (NO)
 Polska (PL)
Polska (PL)
 Schweiz (DE)
Schweiz (DE)
 Singapore (EN)
Singapore (EN)
 Sverige (SV)
Sverige (SV)
 Suomi (FI)
Suomi (FI)
 Türkiye (TR)
Türkiye (TR)