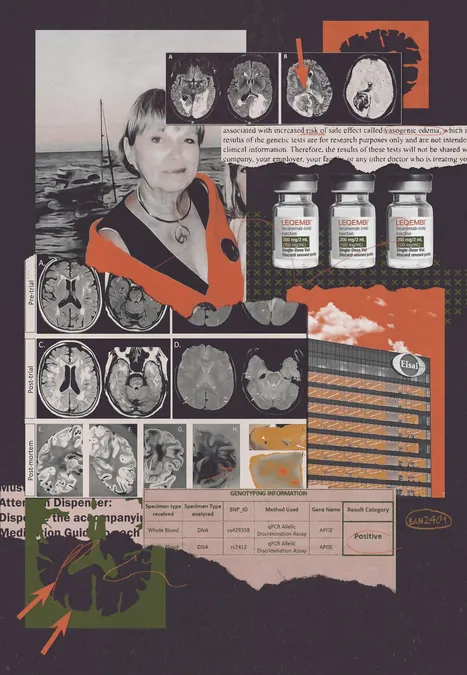
Os Segredos Sombrio na Pesquisa do Medicamento para Alzheimer que Ninguém Te Contou
2024-11-03
Autor: Maria
Investigação sobre a transparência nos ensaios clínicos
Um novo estudo está revelando verdades perturbadoras sobre os ensaios clínicos de medicamentos para Alzheimer, revelando que os fabricantes de medicamentos, como a Eisai, podem não ter sido completamente transparentes com os voluntários. Ao incluir participantes com perfis genéticos que os tornavam altamente vulneráveis aos riscos graves do tratamento, a empresa omitiu informações cruciais que poderiam ter influenciado a decisão dos voluntários em participar.
O caso do Leqembi e os riscos associados
A Eisai conduziu ensaios clínicos para seu medicamento Leqembi, buscando voluntários que, segundo suas características genéticas, gerariam uma resposta significativa ao tratamento. No entanto, muitos desses participantes apresentaram maior risco de complicações severas, como micro-hemorragias cerebrais. A situação gerou preocupação quando documentos revelaram que 274 voluntários não foram informados de que estavam entre os de alto risco.
Experiência de Genevieve Lane
Genevieve Lane, de 79 anos, foi uma das voluntárias que pagaram um preço caro por essa falta de transparência. Após receber o medicamento, foram encontradas 51 micro-hemorragias em seu cérebro. Um exame post-morte concluiu que os efeitos colaterais do Leqembi contribuíram significativamente para sua morte. Esta não é uma história isolada, pois outros voluntários também sofreram complicações semelhantes, levantando sérias questões sobre a ética das decisões de pesquisa.
Críticas à aprovação do Leqembi
Além disso, a aprovação do Leqembi pela FDA foi baseada em uma leve desaceleração do declínio cognitivo, mas muitos especialistas criticam que este benefício não compensa os riscos associados. A situação se complica ainda mais com a aprovação do Kisunla, um medicamento similar da Eli Lilly, que enfrentou problemas idênticos em sua pesquisa, onde 289 voluntários também não foram informados sobre seus riscos aumentados.
Questões éticas e falta de informação
As críticas vão além: bioeticistas e especialistas em Alzheimer questionam a moralidade de não informar aos participantes sobre seus riscos genéticos. George Perry, editor do "Journal of Alzheimer’s Disease", declarou que a falta de transparência mina o consentimento informado, que é um pilar fundamental da ética médica.
Efeitos adversos e novas direções na pesquisa
Os efeitos adversos associados a medicamentos anti-amiloide, como o Leqembi e o Kisunla, continuam a gerar polêmica. A FDA agora exige que os desenvolvedores incluam avisos sobre os potenciais riscos, sugerindo que pessoas com certas características genéticas devem evitar os tratamentos. Recentes estudos até mesmo sugerem uma relação entre esses medicamentos e uma taxa de mortalidade mais alta entre usuários em comparação com aqueles que não fazem uso.
Rumo a uma nova abordagem na pesquisa do Alzheimer
Os ensaios clínicos com foco na proteína beta-amiloide, considerados um marco na pesquisa do Alzheimer, precisam de uma abordagem renovada. Muitos especialistas agora defendem investigações que explorem outras causas potenciais da doença, em vez de se concentrarem exclusivamente na amiloide.
Uma chamada à ação para a ética na pesquisa
A luta contra o Alzheimer continua e, enquanto alguns esperam encontrar uma cura, a história dos voluntários revela uma sombra de incertezas e riscos que não podem ser ignorados. Este é um chamado à ação para que a ética na pesquisa seja reavaliada e o bem-estar dos participantes seja sempre priorizado. Afinal, a vida e a dignidade dos pacientes devem estar em primeiro lugar.
 Brasil (PT)
Brasil (PT)
 Canada (EN)
Canada (EN)
 Chile (ES)
Chile (ES)
 España (ES)
España (ES)
 France (FR)
France (FR)
 Hong Kong (EN)
Hong Kong (EN)
 Italia (IT)
Italia (IT)
 日本 (JA)
日本 (JA)
 Magyarország (HU)
Magyarország (HU)
 Norge (NO)
Norge (NO)
 Polska (PL)
Polska (PL)
 Schweiz (DE)
Schweiz (DE)
 Singapore (EN)
Singapore (EN)
 Sverige (SV)
Sverige (SV)
 Suomi (FI)
Suomi (FI)
 Türkiye (TR)
Türkiye (TR)