¡Revolución en Europa! El lecanemab contra el alzhéimer recibe luz verde, pero con advertencias
2024-11-14
Autor: Ana
El Comité de Expertos de la Agencia Europea del Medicamento (EMA) ha sorprendido al mundo este jueves al recomendar la aprobación del lecanemab, un medicamento que ha sido objeto de controversia debido a sus efectos secundarios y su elevado coste. Este tratamiento es el primero en demostrar cierta efectividad contra el alzhéimer en varias décadas, lo que ha generado tanto esperanza como escepticismo en la comunidad médica.
La EMA reunió nuevamente a sus expertos tras la apelación de los fabricantes del fármaco, quienes habían impugnado la decisión inicial que rechazaba el tratamiento el pasado verano. En esta nueva resolución, se ha recomendado el uso del lecanemab, pero únicamente para aquellos pacientes que no tengan más de una copia del gen APOE4, es decir, el 85% de la población no está excluido. Esto es crucial, ya que las personas con dos copias de este gen presentan un mayor riesgo de inflamación cerebral y hemorragias asociadas al fármaco.
Se espera que la EMA siga estas recomendaciones y apruebe el uso del medicamento en toda la Unión Europea. Sin embargo, cada país tendrá que negociar por separado el precio y decidir si lo incluirá en sus sistemas de salud pública. En Estados Unidos, donde el lecanemab ya es una realidad, su coste asciende a 26,500 dólares anuales, lo que equivale a aproximadamente 24,000 euros.
Los hallazgos de un ensayo clínico realizado con 1,700 pacientes, incluyendo a españoles, indican que el lecanemab puede retrasar el avance de la enfermedad en un 27%. Sin embargo, surge la pregunta crucial: ¿realmente esto se traduce en una mejora significativa para los pacientes y sus cuidadores? Durante el ensayo, se reportó que el 12% de los pacientes experimentaron inflamación cerebral y dos de ellos fallecieron debido a hemorragias cerebrales.
Los fabricantes, la japonesa Eisai y la estadounidense Biogen, han presentado datos adicionales que sugieren que las mejoras en la cognición se mantienen si el tratamiento continúa. Aunque afirmaron que no ha habido más muertes relacionadas, estos datos aún no han sido evaluados por expertos independientes ni han sido publicados en revistas científicas reconocidas.
Europa se une a otros países que ya han autorizado el lecanemab, como Estados Unidos, Japón y China. Por otro lado, el Reino Unido ha decidido aprobar su uso, pero su sistema de salud público no proporcionará financiamiento debido a la relación coste-beneficio considerada insuficiente.
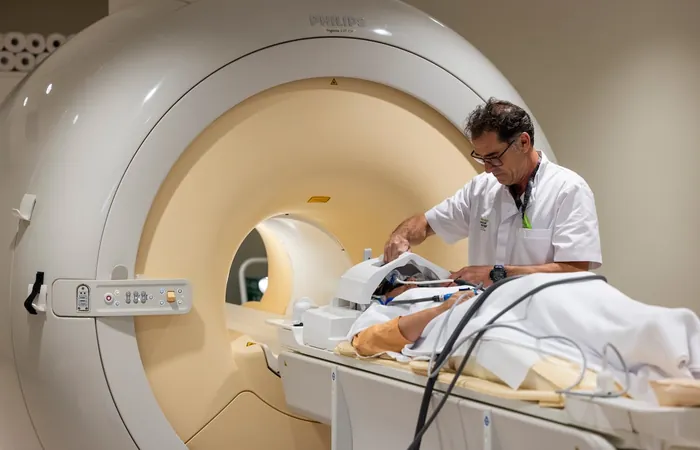
El lecanemab estará disponible a través de un programa de acceso controlado para garantizar su utilización en la población adecuada. Se exigirán resonancias magnéticas para evaluar la inflamación cerebral antes y durante el tratamiento. Además, la EMA impondrá a las farmacéuticas la obligación de proporcionar guías y programas de capacitación para profesionales de la salud sobre los potenciales efectos secundarios del fármaco.
El alzhéimer, que afecta a más de 50 millones de personas en el mundo, sigue siendo la principal causa de demencia y las proyecciones indican que esta cifra podría incrementarse exponencialmente debido al envejecimiento de la población. En España, se estima que solo un 2.5% de las 800,000 personas que padecen alzhéimer podrían beneficiarse de este tratamiento, según Raquel Sánchez del Valle, coordinadora de la Sociedad Española de Neurología.
El lecanemab actúa como un anticuerpo monoclonal que elimina las placas de proteína amiloide del cerebro, las cuales se vinculan al desarrollo del alzhéimer. Para ser eficaz, debe administrarse en etapas muy iniciales de la enfermedad, donde los pacientes todavía pueden llevar una vida independiente, pero comienzan a experimentar pequeñas pérdidas de memoria.
Además del alto precio del fármaco, su administración implica desafíos logísticos considerables para los sistemas de salud. Esto incluye pruebas diagnósticas hospitalarias, inyecciones intravenosas cada 15 días y múltiples escáneres cerebrales para monitorear posibles efectos adversos, lo que podría incrementar el coste total por paciente a cerca de 40,000 euros anuales.
Bart De Strooper, cofundador del Instituto de Investigación de Demencia del Reino Unido, expresó su satisfacción por esta reciente decisión, esperando que impulse la investigación de anticuerpos similares. Por su parte, Juan Fortea, neurólogo del Hospital Sant Pau de Barcelona, celebró este cambio como un avance crucial, destacando que aunque el uso de lecanemab será restringido, representará un progreso significativo en la lucha contra el alzhéimer y fomentará el desarrollo de capacidades diagnósticas y terapéuticas necesarias para el futuro.


 Brasil (PT)
Brasil (PT)
 Canada (EN)
Canada (EN)
 Chile (ES)
Chile (ES)
 España (ES)
España (ES)
 France (FR)
France (FR)
 Hong Kong (EN)
Hong Kong (EN)
 Italia (IT)
Italia (IT)
 日本 (JA)
日本 (JA)
 Magyarország (HU)
Magyarország (HU)
 Norge (NO)
Norge (NO)
 Polska (PL)
Polska (PL)
 Schweiz (DE)
Schweiz (DE)
 Singapore (EN)
Singapore (EN)
 Sverige (SV)
Sverige (SV)
 Suomi (FI)
Suomi (FI)
 Türkiye (TR)
Türkiye (TR)